ELCC 2022丨程颖教授点评:预测新辅助免疫治疗pCR人群,免疫基因特征作为标志物的价值
来源:ioncology 时间:2022-04-06 浏览: 次
编者按:新辅助免疫治疗是实体肿瘤领域近年来的研究热点,但目前尚缺乏公认的预测性生物标志物。在2022年欧洲肺癌大会(ELCC)的小型口头报告专场,一项研究介绍了免疫基因特征作为生物标志物的新发现(2022 ELCC,Abs 157MO)。《肿瘤瞭望》邀请吉林省肿瘤医院程颖教授对这项研究结果予以点评。

研究内容
157MO-Immune gene signatures for predicting pathological response of NSCLC patients treated with neoadjuvant chemoimmunotherapy
免疫基因特征可预测新辅助化疗免疫治疗后的病理缓解情况
背景:新辅助化疗联合免疫疗法(CI)对于非小细胞肺癌(NSCLC)是一种很有前途的策略,可产生与长期生存相关的较高完全病理缓解率(pCR)。基于NADIM试验患者的样本,我们分析了pCR患者和非pCR患者的肿瘤微环境的基因表达谱,以确定可预测pCR的生物标志物。
方法:在参加NADIM试验(NCT03081689)的14名患者中,研究使用Oncomine®面板(Oncomine Immune Response Research Assay panel)对治疗前肿瘤整个切片中提取的RNA进行测序。使用DESeq2和基因集富集分析(GSEA)评估基因表达的组间差异以及进行通路富集分析。CIBERSORTx用于评估免疫细胞亚型的比例,分析达到完全病理缓解(pCR,n=9)和未达到完全缓解(非pCR,n=5)的应答者的结果有何差异。
结果:在pCR和非pCR患者之间,研究鉴定出25个基因的表达存在差异。其中,与非pCR患者相比,pCR患者中17种基因表达上调,主要包括参与II型干扰素信号传导的标志物(FASLG、CXCL13、CXCL10、CXCL9和IFNG)、NK细胞标志物(NCR1、KIR2DL3、GNLY)或淋巴细胞富集(NKG7、GZMB);另外8种基因表达下调。这一发现描绘了pCR患者在治疗前肿瘤样本中的促炎表型(pro-inflammatory phenotype)。
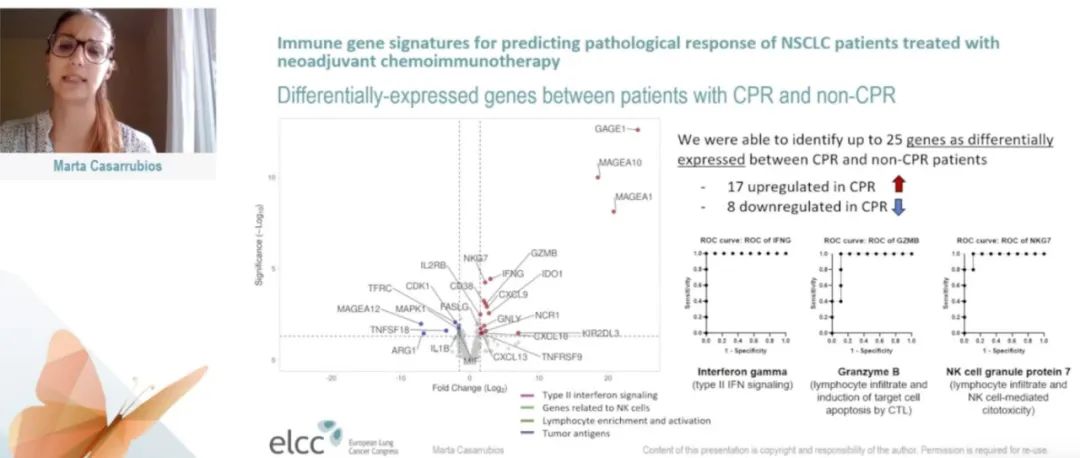
图1. pCR和非pCR患者的25种基因表达存在差异
GSEA分析也显示,在pCR患者中,与TCR共表达、淋巴细胞浸润、II型干扰素信号传导和抗原加工相关的通路上调,以及与肿瘤标志物、增殖或PD-1信号传导相关的通路下调。
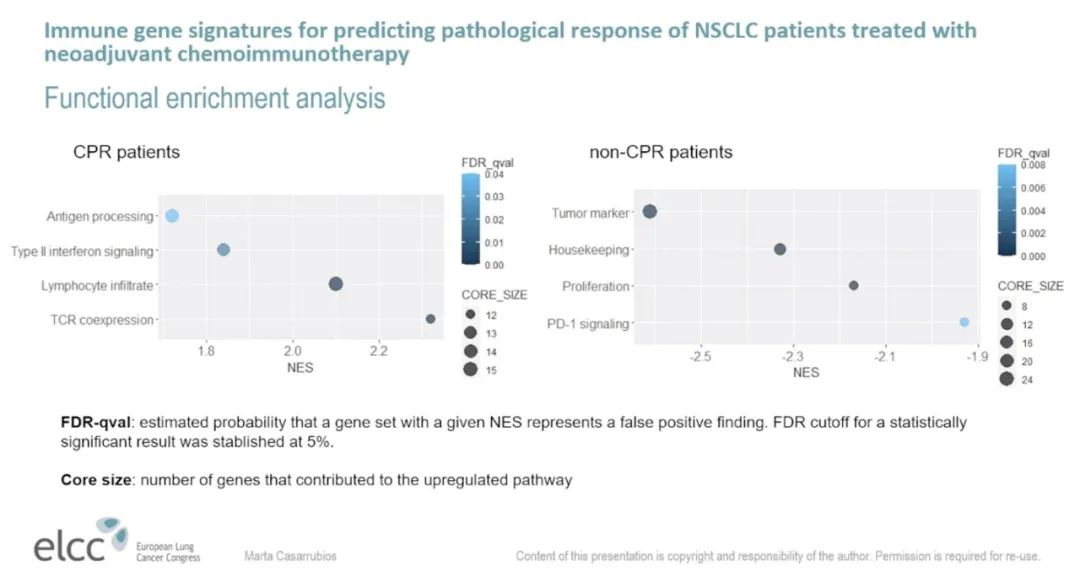
图2. pCR患者中TCR共表达、淋巴细胞浸润、II型干扰素信号传导和抗原加工相关的通路上调
与非pCR患者相比,pCR患者的滤泡辅助性 T细胞、活化NK细胞、M1巨噬细胞、静息树突状细胞的比例和免疫细胞绝对评分更高,M1巨噬细胞的比例存在显著差异(p=0.002)。IFNG、GZMB表达或M1巨噬细胞比例预测治疗反应的AUC ROC分别为1.000(p=0.0027)、0.911(p=0.0136)和0.9778(p=0.004)。
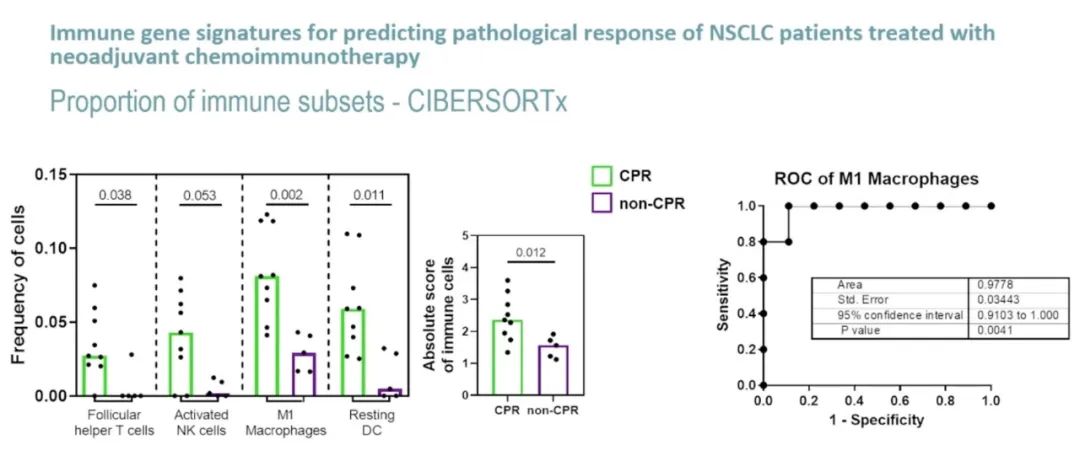
图3. pCR和非pCR患者的滤泡辅助T细胞、活化NK细胞、M1巨噬细胞、静息树突状细胞和免疫细胞之间的差异
结论:这项研究采用RNA测序技术,分析了新辅助免疫联合化疗前的肿瘤组织中的促炎表型,发现IIIA期NSCLC患者的免疫基因特征与新辅助免疫联合化疗后能否达到pCR相关。
程颖教授点评
新辅助免疫治疗是实体肿瘤领域近年来的研究热点,为NSCLC临床实践带来历史性突破。2022年3月,FDA批准第一个新辅助免疫疗法,纳武利尤单抗联合含铂双药化疗用于新辅助治疗可切除NSCLC患者,随后NCCN指南第三版内容首次推荐为NSCLC新辅助免疫治疗方案,NSCLC新辅助治疗正式进入了免疫治疗时代。然而,如何发现新辅助免疫治疗的疗效预测标志物,有效筛选获益人群是新辅助免疫治疗临床应用面临的主要问题。鉴于目前尚缺乏共识的生物标志物,多项研究进行了不同方面的探索。PD-L1和TMB是晚期NSCLC免疫治疗中明确的生物标志物,针对其在新辅助免疫治疗中的作用也有较多探索。
PD-L1和TMB作为标志物的研究发现
早期CheckMate-159研究发现,PD-L1表达阳性与阴性的患者均对纳武利尤单抗新辅助免疫治疗有反应,PD-L1表达与主要病理学缓解(MPR)没有显著相关性。但随后LCMC3和NEOSTAR两项研究显示阿替利珠单抗或纳武利尤单抗联合伊匹木单抗新辅助免疫治疗前PD-L1高表达患者更易达到MPR。LCMC3研究中PD-L1<1%和≥1%患者MPR的比例分别为16%和29%,NEOSTAR研究中MPR患者对比非MPR患者,PD-L1表达中位值分别为80%和1%。PD-L1免疫疗效预测作用的不一致也体现在免疫辅助治疗研究中,IMpower 010研究显示PD-L1表达与阿替利珠单抗辅助治疗疗效有关,但在2022年3月份刚刚公布的KEYNOTE 091研究中却发现PD-L1与帕博利珠单抗疗效不具有相关性。
针对TMB,CheckMate-159研究提示WES检测肿瘤组织TMB在MPR和非MPR患者中平均数值分别为311±55和74±60(p=0.01),提示TMB与MPR存在正相关;但LCMC3研究中未发现WES检测组织TMB与MPR之间具有相关性(p=0.48)。
PD-L1和TMB在不同研究中的预测结果的不一致性,可能由于不同临床试验之间MPR判定存在差异,以及研究药物、样本量、组织学类型分布、治疗时长等不同。PD-L1表达和TMB在早期可切除NSCLC中相对低,且治疗周期也比晚期患者相对少,这些因素也可能影响了PD-L1表达和TMB在新辅助治疗的预测价值。
最近,广州医科大学附属第一医院何建行、梁文华教授针对10项研究共461名NSCLC患者进行的荟萃分析表明:对于可切除NSCLC患者,治疗前PD-L1高表达/高TMB与新辅助免疫治疗后更好的病理学缓解相关,且无论是单药免疫、双药免疫或免疫联合化疗,PD-L1高表达/高TMB都可预测更好的MPR/pCR率。该研究为临床应用PD-L1与TMB作为新辅助免疫治疗生物标志物提供了大样本的理论依据,但未来仍需要对具体药物方案、检测方法、阳性判定标准等进行前瞻性研究。
液体标本ctDNA分析
此外,也有研究对于液态标志物中的ctDNA进行了探索。CheckMate-816采用了包含多达200个基因突变检测位点的肿瘤WES检测panel对血浆样本进行ctDNA测序分析,发现治疗后ctDNA清除率与MPR高度相关,纳武利尤单抗联合化疗组的ctDNA清除与未清除人群pCR率分别为46%和0,提示未来液态活检可能在预测新辅助免疫治疗获益人群方面发挥重要作用。
肿瘤免疫微环境分析
从肿瘤微环境中免疫系统的角度探索NSCLC新辅助免疫治疗生物标志物也有很多探索性研究,如早期小样本回顾性分析发现新辅助治疗后PET/CT原发灶SUVmax降低,肿瘤浸润淋巴细胞(TILs)、外周血TCR和免疫细胞等标志物可能与新辅助免疫治疗的疗效有关。
2022年ELCC大会西班牙的Casarrubios教授等报道了免疫基因图谱与pCR的关系,该研究采用RNA测序技术,通过分析新辅助免疫联合化疗前的肿瘤标本中免疫基因图谱,发现pCR和非pCR患者之间存在差异性基因表达,主要涉及II型干扰素信号通路(IFNG等)、NK细胞标志物或淋巴细胞富集(GZMB等)。pCR患者的滤泡辅助T细胞、活化NK细胞、M1巨噬细胞、静息树突状细胞的比例和免疫细胞绝对评分更高,M1巨噬细胞比例有显著性差异。但是,本研究仅纳入14例标本,未来需要大样本的研究验证。
针对肿瘤和肿瘤微环境的联合分析,我国学者最近也发表了相关科研成果。中国医学科学院肿瘤医院高树庚教授团队对29例完成2个周期新辅助免疫治疗的术前和术后患者肿瘤标本进行了543个基因的测序和肿瘤免疫微环境分析,发现肿瘤病理缓解与PD-L1表达呈正相关,与拷贝数扩增(CNgain)负荷呈负相关;"TPS联合CNgain负荷"相比单独使用能更好地筛选出MPR患者;CNgain负荷与肿瘤区域CD8+和CD8+PD-1-T细胞浸润呈显著负相关,因此提出PD-L1高表达与低CNgain负荷可以作为联合生物标志物预测NSCLC患者新辅助免疫治疗的MPR。该研究将已知的免疫标志物基因拷贝数及免疫细胞进行了综合分析,对于此研究结论,未来还需要大样本前瞻性的研究进行验证。
未来展望
研究者一直在努力探索免疫治疗生物标志物,已经发现PD-L1表达、TMB、TIL、肿瘤新生抗原、特定基因突变、肠道微生物以及某些液体生物标志物等均可能与免疫治疗的疗效有关。未来可能需要综合评估多种指标:
首先标本来源可能包括血液、肿瘤组织和粪便等;
检测时机可能有治疗前、疗效评价和疾病进展时;
检测方法包括DNA基因组学、RNA转录组学、蛋白质组学等;
检测的对象可能包括肿瘤组学、免疫组学及微生物组学等;
此外,还涉及对检测方法的标准化、对检测结果解读和分析的同质化等方面的探索研究。
总之,通过开展多中心、前瞻性的研究,汇集多维度高水平循证医学证据,建立标准化的预测免疫治疗疗效的模型,最终才能实现精准的肺癌新辅助免疫治疗。
参考文献:1. Casarrubios M, et al. Immune gene signatures for predicting pathological response of NSCLC patients treated with neoadjuvant chemoimmunotherapy. Annals of Oncology (2022) 33 (suppl_2): S105-S110. 10.1016/annonc/annonc86
专家简介

程颖教授
一级教授,博士研究生导师,博士后工作站导师
享受国务院特殊津贴,卫生部突出贡献中青年专家
吉林省肿瘤医院党委书记
吉林省癌症中心主任
吉林省肿瘤医院恶性肿瘤临床研究一体化诊疗中心主任
吉林省肺癌诊疗中心主任
中国临床肿瘤学会(CSCO) 副理事长
CSCO小细胞肺癌专业委员会主任委员
CSCO临床研究专家委员会候任主任委员
中国抗癌协会肺癌专业委员会候任主任委员
CSCO非小细胞肺癌专业委员会副主任委员
CSCO肿瘤大数据专家委员会副主任委员
中华医学会肿瘤学分会肺癌专委会副主任委员
中国医师协会肿瘤多学科诊疗专委会副主任委员
中国医师协会肺癌培训专业委员会副主任委员
全国医师定期考核肿瘤专业编辑专业委员会副主任委员
国家卫生、计生委常见肿瘤规范化诊疗专家组成员
吉林省医师协会肿瘤医师分会主任委员
吉林省医学会肿瘤专业委员会主任委员
担任《中华肿瘤杂志》等多家杂志编委
(来源:《肿瘤瞭望》编辑部)
